مراحل البترول والسلوك الجزيئي
خصائص النفط والغاز
السلوك الجزيئي ومراحل النفطاطوار النفط:
نظرا لبيئة الإنسان المكونة من الأرض والماء والهواء، فمن الممكن أن تكون ملاحظاته العلمية الأولى هي أن المادة موجودة في ثلاث حالات أو أشكال؛ الصلبة والسائلة والغازية. بشكل عام، وجد أن جميع المواد قد توجد في أي من الأشكال الثلاثة التي تسمى مراحل المادة.
سيتم تحديد ما إذا كانت المادة موجودة في الحالة الصلبة أو السائلة أو الغازية من خلال ظروف درجة الحرارة والضغط المؤثرة على المادة. ومن المعروف أن البخار يمكن أن يتحول إلى ماء عن طريق خفض درجة حرارته، كما يمكن أن يتحول الماء إلى ثلج عن طريق خفض درجة حرارته. سوف تغير المركبات الهيدروكربونية، سواء منفردة أو في مخاليط، حالتها أو طورها بنفس الطريقة عن طريق تغيير درجة حرارتها وضغطها. ويسمى التغيير الناتج "سلوك المرحلة".
تتشكل الهيدروكربونات الثقيلة، بما في ذلك البارافين والقطران، بشكل طبيعي في بعض الأحيان كمواد صلبة في المكمن وتمثل مشاكل في عمليات إنتاج النفط؛ ومع ذلك، لا يحدث هذا غالبًا، ولن تتم مناقشة مثل هذه المشكلات هنا. وسوف يقتصر البحث على سلوك الهيدروكربونات عند تغيرها من غاز إلى سائل ومن سائل إلى غاز ومشاكل التشغيل والسيطرة عليها الناتجة عن هذه التغيرات.
السلوك الجزيئي
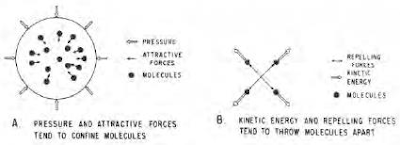
تتصرف الهيدروكربونات بشكل غريب عندما يتغير ضغطها ودرجة حرارتها. أفضل تفسير لهذا السلوك هو سلوك الجزيئات الفردية التي تشكل الخليط. هناك أربعة عوامل فيزيائية مهمة في التحكم في سلوك المادة الهيدروكربونية. وهي:
- الضغط،
- الجذب الجزيئي،
- الطاقة الحركية (الحركة الجزيئية المرتبطة بدرجة الحرارة)،
- التنافر الجزيئي (الشكل).
يميل الضغط والجذب الجزيئي إلى حصر الجزيئات أو جمعها معًا بحيث كلما زادت قيمة هذه القوى، زاد ميل المادة إلى أن تصبح أكثر كثافة، كما هو الحال عندما تصبح الغازات سائلة.
 |
| القوى التي تحكم سلوك الهيدروكربون |
يعتبر الجذب الجزيئي ضغطًا داخليًا لأنه موجود داخل النظام ويعمل على الجزيئات بنفس طريقة الضغط الخارجي. تتغير قوة التجاذب بين الجزيئات بتغير المسافة بين الجزيئات، وتزداد القوة كلما قلت المسافة بين الجزيئات؛ فهي تختلف باختلاف كتلة الجزيئات، إذ تزداد القوة بزيادة كتلة الجزيئات.
تزداد الطاقة الحركية، أو الحركة الجزيئية، مع زيادة درجة الحرارة بحيث كلما زادت درجة حرارة المادة، زاد ميل المادة إلى التفكك، وبالتالي تنخفض الكثافة أو تتغير من سائل إلى غاز (أو لتوسع الغاز).
عندما تقترب الجزيئات من بعضها البعض لدرجة أن مجالاتها الإلكترونية تتداخل، تكون هناك قوة تنافر تميل إلى زيادة مقاومة المادة لمزيد من الضغط. عندما تبدو المادة الهيدروكربونية في حالة سكون (لا تتوسع أو تنكمش في الحجم أو تتغير حالتها)، فإن القوى التي تميل إلى حصر الجزيئات توازن القوى التي تميل إلى تفكيكها، وتعتبر المادة في حالة توازن.
التغييرات في المراحل:
إذا زاد الضغط، تقترب الجزيئات من بعضها البعض بحيث يتم ضغط الغاز أو تحويله إلى سائل. ومع ذلك، مع انخفاض الضغط، يحدث العكس؛ يتوسع الغاز ويميل السائل إلى التبخر إلى الغاز. يتم فصل الجزيئات في الحالة الأخيرة عن بعضها بواسطة طاقتها الحركية وتنافرها الجزيئي. تسمى هذه التغيرات الطورية الناتجة عن التغيرات في الضغط بالسلوك الطبيعي أو المنتظم.
إذا كانت الجزيئات أصغر، كما في حالة الميثان والإيثان، يكون هناك تجاذب أقل بين الجزيئات وميل أكبر للانفصال عن بعضها البعض بواسطة طاقتها الحركية إلى غاز؛ في حين أنه إذا كانت الجزيئات أكبر، كما هو الحال في الهكسان والهيبتان، فإنها تميل إلى الانجذاب معًا إلى السائل بدلاً من طرحها في الحالة الغازية بواسطة طاقاتها الحركية. مع زيادة درجة حرارة المركبات، تزداد الطاقة الحركية. ومن ثم فإن الاتجاه هو أن يتم إلقاء جميع الجزيئات الموجودة في الحالة السائلة في الحالة الغازية وأن تتوسع الغازات. ومع ذلك، إذا انخفضت درجة الحرارة، تنخفض الطاقة الحركية، وتميل جميع الجزيئات (حتى الجزيئات الأخف) إلى الانجذاب معًا إلى الحالة السائلة وحتى التجمد في الحالة الصلبة إذا كانت درجة الحرارة منخفضة بدرجة كافية. يعتبر هذا السلوك أيضًا عاديًا أو منتظمًا.
كلمات مفتاحية: اطوار، مراحل، بترول، غاز، نفط.

تعليقات
إرسال تعليق