التغيرات في مراحل البترول
خصائص النفط والغاز
التغيرات في الاطوار
إذا زاد الضغط، تقترب الجزيئات من بعضها البعض بحيث يتم ضغط الغاز أو تحويله إلى سائل. ومع ذلك، عند انخفاض الضغط، يحدث العكس، حيث يتوسع الغاز ويميل السائل إلى التبخر إلى الغاز. يتم فصل الجزيئات في الحالة الأخيرة عن بعضها بواسطة طاقتها الحركية وتنافرها الجزيئي. تسمى هذه التغيرات الطورية الناتجة عن التغيرات في الضغط تعرف بالسلوك الطبيعي أو المنتظم.
إذا كانت الجزيئات أصغر، كما في حالة الميثان والإيثان، يكون هناك تجاذب أقل بين الجزيئات وميل أكبر للانفصال عن بعضها البعض بواسطة طاقتها الحركية والتحول الى غاز؛ في حين أنه إذا كانت الجزيئات أكبر، كما هو في حالة الهكسان والهيبتان، فإنها تميل إلى الانجذاب معًا والتحول إلى السائل بدلاً من طرحها في الحالة الغازية بواسطة طاقاتها الحركية. مع زيادة درجة حرارة المركبات، تزداد الطاقة الحركية. ومن ثم فإن الاتجاه هو أن يتم إلقاء جميع الجزيئات الموجودة في الحالة السائلة في الحالة الغازية وأن تتوسع الغازات. ومع ذلك، إذا انخفضت درجة الحرارة، تنخفض الطاقة الحركية، وتميل جميع الجزيئات (حتى الجزيئات الأخف) إلى الانجذاب معًا إلى الحالة السائلة حتى تصل الى التجمد وتتحول الى الحالة الصلبة إذا كانت درجة الحرارة منخفضة بدرجة كافية. يعتبر هذا السلوك أيضًا عاديًا أو منتظمًا.
الهيدروكربونات النقية
بالنسبة للهيدروكربون المفرد أو النقي مثل البروبان أو البيوتان أو البنتان، هناك ضغط معين لكل درجة حرارة يمكن أن يتواجد فيها الهيدروكربون كسائل وغاز. وهذا موضح في الشكل. في ظل هذه الظروف، تعمل القوى التي تميل إلى تقريب الجزيئات من بعضها البعض (قوى الضغط والتجاذب) على موازنة الطاقة الحركية التي تميل إلى إبعادها. إذا زاد الضغط دون تغير في درجة الحرارة، فإن جزيئات الغاز تقترب من بعضها البعض وبالتالي تزداد قوى التجاذب بين الجزيئات. وتكون القوى التي تميل إلى سحب الجزيئات معًا أكبر من الطاقة الحركية، وتتكثف الجزيئات إلى الحالة السائلة.
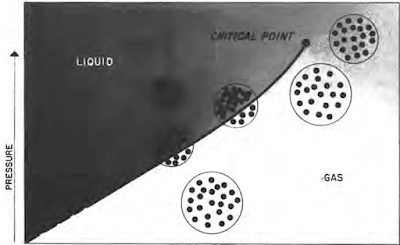 |
| ضغط البخار مقابل درجة الحرارة لمكون هيدروكربوني نقي |
أما إذا انخفض الضغط دون تغير في درجة الحرارة، فإن المسافة بين جزيئات الغاز تزداد، وبالتالي تقل قوى التجاذب. عندئذ تكون القوى التي تعمل على جمع الجزيئات معًا أقل من الطاقة الحركية، وتنتشر الجزيئات متحولة إلى غاز.
في الواقع، ينتج الضغط عن القصف الجزيئي للوعاء الذي يحتوي على السائل والسطح السائل. تميل الزيادة في الحجم إلى تقليل الضغط عن طريق زيادة المسافة التي يجب أن تتحركها الجزيئات لتضرب الحاوية. مع ارتفاع درجة الحرارة، تزداد الطاقة الحركية. مطلوب ضغوط أعلى لوجود الظروف المتوازنة التي يمكن أن تتواجد فيها المرحلتان في وقت واحد. ويسمى المنحنى المرسوم عبر نقاط الضغط ودرجة الحرارة حيث توجد مرحلتين "منحنى ضغط البخار". هناك درجة حرارة لن تتواجد المادة فوقها على مرحلتين بغض النظر عن الضغط. وهذا ما يسمى "النقطة الحرجة"، وتسمى درجة الحرارة والضغط عند هذه النقطة "درجة الحرارة الحرجة" و"الضغط الحرج".
ومن الممارسات الشائعة اعتبار المادة غازًا عندما تكون موجودة في ظروف درجة الحرارة والضغط أسفل منحنى ضغط البخار، وكسائل فوق منحنى ضغط البخار. من الواضح أن مثل هذا التعريف مربك لأنه توجد نطاقات من درجات الحرارة والضغط يمكن من خلالها تصنيف المادة على أنها سائلة أو غازية. وتظهر هذه النطاقات في الجزء العلوي الأيمن من الشكل. في هذه النطاقات، تكون درجة الحرارة كبيرة جدًا لدرجة أن قوى التجاذب بين الجزيئات ليست كبيرة بما يكفي للسماح لها بالتجمع في الطور السائل بسبب الطاقة الحركية الأعلى للجزيئات في حالة درجة الحرارة المرتفعة. في ظل ظروف درجة الحرارة هذه، تؤدي زيادة الضغط إلى تحرك الجزيئات معًا بشكل موحد مع زيادة الضغط. يتم تقليل هذا الارتباك عند العمل مع الخزانات لأن درجة حرارة الخزان (وبالتالي درجة حرارة الهيدروكربونات في الخزان) تظل ثابتة عادةً؛ ولذلك، عادة ما يتم تغيير الضغط والحجم فقط إلى درجة ملحوظة في المكمن أثناء الإنتاج.
كلمات مفتاحية: تغير الاطوار، هيدروكربون نقي، سائل، غاز، بخار

تعليقات
إرسال تعليق